Alcanos, ¿Qué son los alcanos?
Los alcanos, llamados también parafinas, tienen solamente enlaces simples en sus moléculas y, por eso se les conoce como hidrocarburos saturados, estos compuestos son relativamente inertes (que no reaccionan). A los compuestos orgánicos constituidos únicamente por carbono e hidrógeno se les conoce con el nombre de hidrocarburos.
Los hidrocarburos mas sencillos son los alcanos, todos los enlaces en estas moléculas son covalentes simples, se pueden considerar como no polares por la geometría de las moléculas y por la escasa polaridad del enlace C-H.
Los alcanos de uso industrial no se sintetizan en el laboratorio, sino que se obtienen de sus fuentes naturales. Las principales fuentes de hidrocarburos, en la actualidad, las constituyen el gas natural y el petróleo.
 El gas natural se compone principalmente de metano y, en un 10% de etano y propano, junto a unas trazas de hidrocarburos con cinco a seis carbonos; el gas natural, una vez purificado, se utiliza exclusivamente como combustible y el petroleo es una mezcla compleja de hidrocarburos formados durante el transcurso del tiempo al descomponerse, gradualmente la materia vegetal y animal enterrada y sometida a grandes presiones por las capas geológicas. El petroleo tal como se extrae de las grandes profundidades, es un liquido viscoso de color negro.
El gas natural se compone principalmente de metano y, en un 10% de etano y propano, junto a unas trazas de hidrocarburos con cinco a seis carbonos; el gas natural, una vez purificado, se utiliza exclusivamente como combustible y el petroleo es una mezcla compleja de hidrocarburos formados durante el transcurso del tiempo al descomponerse, gradualmente la materia vegetal y animal enterrada y sometida a grandes presiones por las capas geológicas. El petroleo tal como se extrae de las grandes profundidades, es un liquido viscoso de color negro.
Los alcanos son compuestos muy poco reactivos por la naturaleza de sus enlaces: covalentes no polares, esta propiedad hace que muchas veces se utilicen como disolventes. A causa de su poca reactividad, se les llama también "parafinas", del latin parum affinis que significa poca afinidad.
El alcano, y también la molécula orgánica mas pequeña, es el metano; su formula molecular es CH4. Esta sustancia es un gas a temperatura ambiente, es el componente principal del gas natural; se le llama "gas de los pantanos", pues se forma por descomposición bacteriana de la materia orgánica vegetal acumulada en el fondo de zonas pantanosas.
A continuación el nombre y fórmula de los primeros diez alcanos de cadena lineal:
Nombre (IUPAC) Fórmula molécular Fórmula estructural
Los nombres incluidos en el cuadro siguen las relgas del sistema de nomenclatura establecido por la Unión Internacional de Química Pura y Aplicada, IUPAC por sus siglas en inglés. En el caso de los alcanos el sistema IUPAC emplea la terminación "ano" al final dde cada uno de los prefijos que indican el número de carbonos. Los prefijos son: met (1C), et (2C), prop (3C), but (4C), pent (5C), hex (6C), hept (7C), oct (8C), non (9C), dec (10), undec (11), dodec (12).
El alcano, y también la molécula orgánica mas pequeña, es el metano; su formula molecular es CH4. Esta sustancia es un gas a temperatura ambiente, es el componente principal del gas natural; se le llama "gas de los pantanos", pues se forma por descomposición bacteriana de la materia orgánica vegetal acumulada en el fondo de zonas pantanosas.
A continuación el nombre y fórmula de los primeros diez alcanos de cadena lineal:
Nombre (IUPAC) Fórmula molécular Fórmula estructural
Metano CH4 CH4
Etano C2H6 CH3-CH3
Propano C3H8 CH3-CH2-CH3
Butano C4H10 CH3-CH2-CH2-CH3
Pentano C5H12 CH3-CH2-CH2-CH2-CH3
Hexano C6H14 CH3-CH2-CH2-CH2-CH2-CH3
Heptano C7H16 CH3-CH2-CH2-CH2-CH2-CH2-CH3
Octano C8H18 CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3
Nonano C9H20 CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3
Decano C10H22 CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3
Los nombres incluidos en el cuadro siguen las relgas del sistema de nomenclatura establecido por la Unión Internacional de Química Pura y Aplicada, IUPAC por sus siglas en inglés. En el caso de los alcanos el sistema IUPAC emplea la terminación "ano" al final dde cada uno de los prefijos que indican el número de carbonos. Los prefijos son: met (1C), et (2C), prop (3C), but (4C), pent (5C), hex (6C), hept (7C), oct (8C), non (9C), dec (10), undec (11), dodec (12).
Bibliografía:
Arias, F. (2006). Química orgánica. 1era Edición. Editorial Universidad Estatal a Distancia. San José, Costa Rica. Cáp. 2. - Consultado de manera electrónica, a traves del enlace:
Arias, F. (2006). Química orgánica. 1era Edición. Editorial Universidad Estatal a Distancia. San José, Costa Rica. Cáp. 2. - Consultado de manera electrónica, a traves del enlace:
books.google.es/books?id=TL98uAXZ3JQC&printsec=frontcover&dq=quimica+organica&hl=es&sa=X&ei=_BwiU6q7II6NkAfPloGICA&ved=0CDsQ6AEwAA#v=onepage&q&f=true
MARÍA VERÓNICA LEÓN
10 de abril del 2014
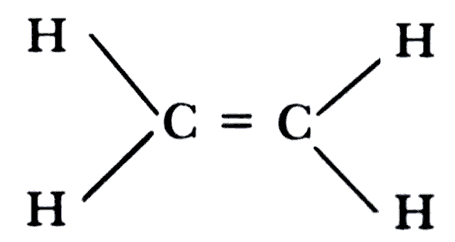 En consecuencia, comenzamos conectando los átomos de carbono con un enlace covalente y luego unimos a cada uno de ellos dos átomos de hidrógeno. En esta etapa, cada carbono tiene solamente seis electrones de valencia, en vez de los ocho requeridos, y a la molécula entera aun le falta un par para ser neutra. Podemos resolver ambos problemas si damos por sentado que los carbonos pueden compartir dos pares de electrones y, para describir esta situación, decimos que están unidos por un doble enlace. El doble enlace de los carbonos es el rasgo característico de la estructura de los alquenos.
En consecuencia, comenzamos conectando los átomos de carbono con un enlace covalente y luego unimos a cada uno de ellos dos átomos de hidrógeno. En esta etapa, cada carbono tiene solamente seis electrones de valencia, en vez de los ocho requeridos, y a la molécula entera aun le falta un par para ser neutra. Podemos resolver ambos problemas si damos por sentado que los carbonos pueden compartir dos pares de electrones y, para describir esta situación, decimos que están unidos por un doble enlace. El doble enlace de los carbonos es el rasgo característico de la estructura de los alquenos.
 El petróleo y el gas natural proporcionan los alcanos que son la principal fuente primaria de productos orgánicos: sustancias en torno a las que se han desarrollado una industria vastísima, y que utilizamos en laboratorio. Los alcanos se obtienen, mediante el cracking en sus diversas formas, ciertas sustancias más reactivas: los hidrocarburos aromáticos benceno, tolueno y los xilenos; y los alquenos menores etileno, propileno y butilenos. En último término, la mayoria de los productos aromáticos y alifáticos se obtiene de estos pocos compuestos más metano. El etileno por ejemplo, es el compuesto orgánico de mayor consumo en la industria química. Al contrario de los alcanos, los alquenos son muy reactivos, debido a su grupo funcional: el doble enlace carbono-carbono. No solo sufren de una amplia gama de reacciones, sino que, además estas ocurren en lugares bien definidos de la molécula: en el propio doble enlace o en ciertas posiciones que poseen una relación especifica con respecto a aquél. Las condiciones en las que los alquenos reaccionan a escala industrial pueden, por razones practicas y económicas, diferir ampliamente de las que se utilizan en el laboratorio.
El petróleo y el gas natural proporcionan los alcanos que son la principal fuente primaria de productos orgánicos: sustancias en torno a las que se han desarrollado una industria vastísima, y que utilizamos en laboratorio. Los alcanos se obtienen, mediante el cracking en sus diversas formas, ciertas sustancias más reactivas: los hidrocarburos aromáticos benceno, tolueno y los xilenos; y los alquenos menores etileno, propileno y butilenos. En último término, la mayoria de los productos aromáticos y alifáticos se obtiene de estos pocos compuestos más metano. El etileno por ejemplo, es el compuesto orgánico de mayor consumo en la industria química. Al contrario de los alcanos, los alquenos son muy reactivos, debido a su grupo funcional: el doble enlace carbono-carbono. No solo sufren de una amplia gama de reacciones, sino que, además estas ocurren en lugares bien definidos de la molécula: en el propio doble enlace o en ciertas posiciones que poseen una relación especifica con respecto a aquél. Las condiciones en las que los alquenos reaccionan a escala industrial pueden, por razones practicas y económicas, diferir ampliamente de las que se utilizan en el laboratorio.
Consultado de manera electrónica el 9/4/2014 mediante el siguiente enlace:
http://books.google.es/books?id=N0kLiQ-fnjgC&pg=PA420&dq=alquenos&hl=es&sa=X&ei=2wlHU_G7Lsed0gGW2oGoAQ&ved=0CEYQ6AEwAw#v=onepage&q=alquenos&f=false
MARÍA VERÓNICA LEÓN
10 de abril del 2014
ALQUENOS
El miembro mas sencillo de la familia de los alquenos es el etileno, C2H4. En vista de la fácil conversión de etileno en etano, es razonable suponer que ambos tienen cierta similitud estructural.
 En consecuencia, comenzamos conectando los átomos de carbono con un enlace covalente y luego unimos a cada uno de ellos dos átomos de hidrógeno. En esta etapa, cada carbono tiene solamente seis electrones de valencia, en vez de los ocho requeridos, y a la molécula entera aun le falta un par para ser neutra. Podemos resolver ambos problemas si damos por sentado que los carbonos pueden compartir dos pares de electrones y, para describir esta situación, decimos que están unidos por un doble enlace. El doble enlace de los carbonos es el rasgo característico de la estructura de los alquenos.
En consecuencia, comenzamos conectando los átomos de carbono con un enlace covalente y luego unimos a cada uno de ellos dos átomos de hidrógeno. En esta etapa, cada carbono tiene solamente seis electrones de valencia, en vez de los ocho requeridos, y a la molécula entera aun le falta un par para ser neutra. Podemos resolver ambos problemas si damos por sentado que los carbonos pueden compartir dos pares de electrones y, para describir esta situación, decimos que están unidos por un doble enlace. El doble enlace de los carbonos es el rasgo característico de la estructura de los alquenos.
Como clase, los alquenos poseen propiedades físicas esencialmente iguales que las de los alcanos. Son insolubles en agua, pero bastante solubles en líquidos no polares, como benceno, éter, cloroformo o logroína, y son menos densos que el agua. El punto de ebullición aumenta con el número creciente de carbonos, como en el caso de los alcanos, el aumento del punto de ebullición es de 20 a 30 grados por cada carbono adicional, excepto para los homólogos muy pequeños. Las ramificaciones bajan el punto de ebullición. Al igual que los alcanos, los alquenos son, a lo sumo, solo débilmente polares. Puesto que los electrones π muy sueltos del doble enlace se desplazan con facilidad, sus momentos dipolares son mayores que los de los alcanos, sin embargo, son pequeños.
 El petróleo y el gas natural proporcionan los alcanos que son la principal fuente primaria de productos orgánicos: sustancias en torno a las que se han desarrollado una industria vastísima, y que utilizamos en laboratorio. Los alcanos se obtienen, mediante el cracking en sus diversas formas, ciertas sustancias más reactivas: los hidrocarburos aromáticos benceno, tolueno y los xilenos; y los alquenos menores etileno, propileno y butilenos. En último término, la mayoria de los productos aromáticos y alifáticos se obtiene de estos pocos compuestos más metano. El etileno por ejemplo, es el compuesto orgánico de mayor consumo en la industria química. Al contrario de los alcanos, los alquenos son muy reactivos, debido a su grupo funcional: el doble enlace carbono-carbono. No solo sufren de una amplia gama de reacciones, sino que, además estas ocurren en lugares bien definidos de la molécula: en el propio doble enlace o en ciertas posiciones que poseen una relación especifica con respecto a aquél. Las condiciones en las que los alquenos reaccionan a escala industrial pueden, por razones practicas y económicas, diferir ampliamente de las que se utilizan en el laboratorio.
El petróleo y el gas natural proporcionan los alcanos que son la principal fuente primaria de productos orgánicos: sustancias en torno a las que se han desarrollado una industria vastísima, y que utilizamos en laboratorio. Los alcanos se obtienen, mediante el cracking en sus diversas formas, ciertas sustancias más reactivas: los hidrocarburos aromáticos benceno, tolueno y los xilenos; y los alquenos menores etileno, propileno y butilenos. En último término, la mayoria de los productos aromáticos y alifáticos se obtiene de estos pocos compuestos más metano. El etileno por ejemplo, es el compuesto orgánico de mayor consumo en la industria química. Al contrario de los alcanos, los alquenos son muy reactivos, debido a su grupo funcional: el doble enlace carbono-carbono. No solo sufren de una amplia gama de reacciones, sino que, además estas ocurren en lugares bien definidos de la molécula: en el propio doble enlace o en ciertas posiciones que poseen una relación especifica con respecto a aquél. Las condiciones en las que los alquenos reaccionan a escala industrial pueden, por razones practicas y económicas, diferir ampliamente de las que se utilizan en el laboratorio.
Como ya hemos visto, el rasgo característico de la estructura de un alqueno es el doble enlace carbono-carbono. Este es, por tanto, el grupo funcional de los alquenos, y como tal determina las reacciones características que sufren estos hidrocarburos. Las reacciones son de dos tipos.
- Primero, las que se verifican en el propio doble enlace y, al hacerlo, lo destruyen.
- Segundo, las que suceden, no en el doble enlace. Aparentemente, el doble enlace no está involucrado, ya que aparece intacto el producto. Sin embargo, tiene una participación esencial, aunque oculta, en la reacción: determina la velocidad y el mecanismo de reacción, e incluso si ésta tiene lugar.
Bibliografía consultada:
Morrison R. , Boyd R.(1998) "Química Orgánica" 5ta Edición. Editorial Pearson. México. Cap. 7
Consultado de manera electrónica el 9/4/2014 mediante el siguiente enlace:
http://books.google.es/books?id=N0kLiQ-fnjgC&pg=PA420&dq=alquenos&hl=es&sa=X&ei=2wlHU_G7Lsed0gGW2oGoAQ&ved=0CEYQ6AEwAw#v=onepage&q=alquenos&f=false
MARÍA VERÓNICA LEÓN
No hay comentarios:
Publicar un comentario